慢性中心性浆液性脉络膜视网膜病变与息肉样脉络膜血管病变多模式影像学特征的比较
摘 要:目的 比较慢性中心性浆液性脉络膜视网膜病变(chronic central serous chorioretinopathy,CCSC)与息肉样脉络膜血管病变(polypoidal choroidal vasculopathy,PCV)的多模式影像学差异。方法 回顾性分析CCSC组11例11眼患者及PCV组21例21眼患者的临床资料。所有患者均行最佳矫正视力、黄斑中心凹下脉络膜厚度测量及荧光素眼底血管造影、吲哚菁绿血管造影、光学相干断层扫描血管成像(optical coherence tomography angiography,OCTA)和频域光学相干断层扫描多模式影像学检查,并对检查结果进行统计学分析。结果 CCSC组患者最佳矫正视力为0.33±0.11,显著高于PCV组(0.21±0.13),差异有统计学意义(P<0.05)。CCSC组患者黄斑中心凹下脉络膜厚度为(368.20±51.65)μm,PCV组为(342.28±37.18)μm,两组相比差异无统计学意义(P>0.05)。荧光素眼底血管造影检查结果显示,CCSC组和PCV组均为斑点状高荧光表现,CCSC组患眼可伴有色素上皮萎缩带或慢性神经上皮脱离通道表现。吲哚菁绿血管造影检查结果显示,CCSC组11眼病灶区出现周围脉络膜血管扩张及高通透性改变;而PCV组21眼均出现脉络膜息肉样病变,其中12眼为脉络膜分支血管网。OCTA检查结果显示,CCSC组4眼病灶部位表现为脉络膜毛细血管层高血流信号,其外环绕低血流信号,7眼表现为粗颗粒形态的斑驳状血流信号;PCV组15眼可检出息肉样病变,表现为高反射信号,呈结节状、环状或点状,12眼检出脉络膜分支血管网病变,表现为血管样结构的高血流信号。频域光学相干断层扫描检查发现,CCSC组7眼为浆液性视网膜色素上皮脱离(pigment epithelium detachment,PED);PCV组12眼为波浪形隆起的视网膜色素上皮层与Bruch膜组成的双层征,10眼为陡峭的视网膜色素上皮指状突起(或称PED峰),18眼为浆液性或出血性PED。CCSC组患者治疗随访时,OCTA检查发现2眼继发I型脉络膜新生血管。结论 CCSC与PCV之间存在不同的影像学表现,多模式影像检查有助于两者的鉴别。另外,OCTA能够较好地显示脉络膜新生血管结构,可用于该类疾病的治疗随访。
关键词:慢性中心性浆液性脉络膜视网膜病变 息肉样脉络膜血管病变 脉络膜新生血管 光学相干断层扫描血管成像 多模式影像检查
慢性中心性浆液性脉络膜视网膜病变(chronic central serous chorioretinopathy,CCSC)和息肉样脉络膜血管病变(polypoidal choroidal vasculopathy,PCV)均为脉络膜肥厚谱系疾病,共同特征有脉络膜血管通透性增高、脉络膜增厚等[1]。近一半CCSC患者在治疗过程中继发脉络膜新生血管(choroidal neovascularization,CNV),甚至进展为PCV[2-3]。这两种疾病的临床表现相似,易出现误诊及治疗偏差,因此对两者进行鉴别尤为重要。随着科技发展,眼底影像学检查方法不断更新,特别是光学相干断层扫描血管成像(optical coherence tomography angiography,OCTA)的应用,为新生血管性疾病的明确诊断提供了新的手段。本研究对CCSC和PCV患者眼底多模式影像学特征进行比较及分析,寻找两者之间的差异。
1 资料与方法
1.1 一般资料
选取2019年2月至2020年2月在苏州大学附属第一医院就诊的33例患者病历资料进行回顾性分析。根据疾病诊断分为两组,CCSC组患者11例(11眼),年龄(52.18±8.58)岁,其中男10例,女1例;PCV组患者21例(21眼),年龄(65.76±7.36)岁,其中男17例,女4例。
1.2 诊断标准
CCSC的诊断标准[4]:病程>6个月或既往有反复发病史,光学相干断层扫描显示视网膜神经上皮浆液性脱离伴有或不伴有视网膜色素上皮脱离(pigment epithelium detachment,PED),荧光素眼底血管造影(fundus fluorescein angiography,FFA)显示单灶或多灶弥漫性荧光素渗漏。PCV的诊断标准(EVEREST标准)[5]:吲哚菁绿血管造影(indocyanine green angiography,ICGA)发现6 min内单发或多发脉络膜循环结节状高荧光病灶,伴以下一项或多项特征:ICGA观察到脉络膜分支血管网(branch vessels network,BVN),动态ICGA可见脉样搏动,ICGA立体观察时呈球形外观,ICGA出现低荧光环,彩色眼底照片上发现视网膜下橘红色结节,伴有大量黄斑下出血。为增加与CCSC组的对比性,本研究中PCV组排除眼底大量出血患者。
1.3 检查方法
所有患者均行最佳矫正视力(best corrected visual acuity,BCVA)、黄斑中心凹下脉络膜厚度(subfoveal choroidal thickness,SFCT)测量及FFA、ICGA、OCTA和频域光学相干断层扫描(spectral-domain optical coherence tomography,SD-OCT)检查。采用海德堡共焦眼底造影系统(德国海德堡公司)进行FFA和ICGA检查;采用RTVue-XR OCT(美国Optovue公司)进行OCTA及SD-OCT检查。使用增强深度成像OCT模式,利用仪器自带软件手动测量SFCT,即黄斑中心凹处从视网膜色素上皮层至脉络膜巩膜交界面的距离。OCTA检查采用黄斑区6 mm×6 mm扫描模式,系统软件自动将组织分成视网膜浅层、视网膜深层、视网膜外层和脉络膜毛细血管层,若自动分层无法定位病灶或获得图像不理想时,改为手动模式调节分层,获得相应部位en-face图像。SD-OCT检查采用线性扫描模式,对于病变不在黄斑区者,手动拖动到对应病灶部位进行扫描。
1.4 统计学方法
采用SPPS 22.0统计学软件进行分析,计量资料采用均数±标准差表示,CCSC组及PCV组BCVA、SFCT比较均采用独立样本t检验。检验水准:α=0.05。
2 结果
2.1 CCSC组与PCV组患者BCVA、SFCT比较
CCSC组患者BCVA(0.33±0.11)显著高于PCV组(0.21±0.13),差异有统计学意义(P<0.05)。CCSC组患者SFCT为(368.20±51.65)μm,PCV组患者为(342.28±37.18)μm,两组相比差异无统计学意义(P>0.05)。
2.2 CCSC组与PCV组患者眼底多模式影像学特征比较
FFA检查结果显示,CCSC组和PCV组均为斑点状高荧光表现,CCSC组患眼可伴有色素上皮萎缩带或慢性神经上皮脱离通道表现。ICGA检查结果显示,CCSC组11眼病灶区出现周围脉络膜血管扩张及高通透性改变;而PCV组21眼均出现脉络膜息肉样病变,其中12眼为BVN。OCTA检查结果显示,CCSC组4眼病灶部位表现为脉络膜毛细血管层高血流信号,其外环绕低血流信号,7眼表现为粗颗粒形态的斑驳状血流信号;PCV组15眼可检出息肉样病变,表现为高反射信号,呈结节状、环状或点状,12眼检出BVN病变,表现为血管样结构的高血流信号。SD-OCT检查发现,CCSC组7眼为浆液性PED;PCV组12眼为波浪样隆起的视网膜色素上皮层与Bruch膜组成的双层征,10眼为陡峭的视网膜色素上皮指状突起(或称PED峰),18眼为浆液性或出血性PED(见图1和图2)。CCSC组患者治疗随访时,OCTA检查发现2眼继发I型CNV。
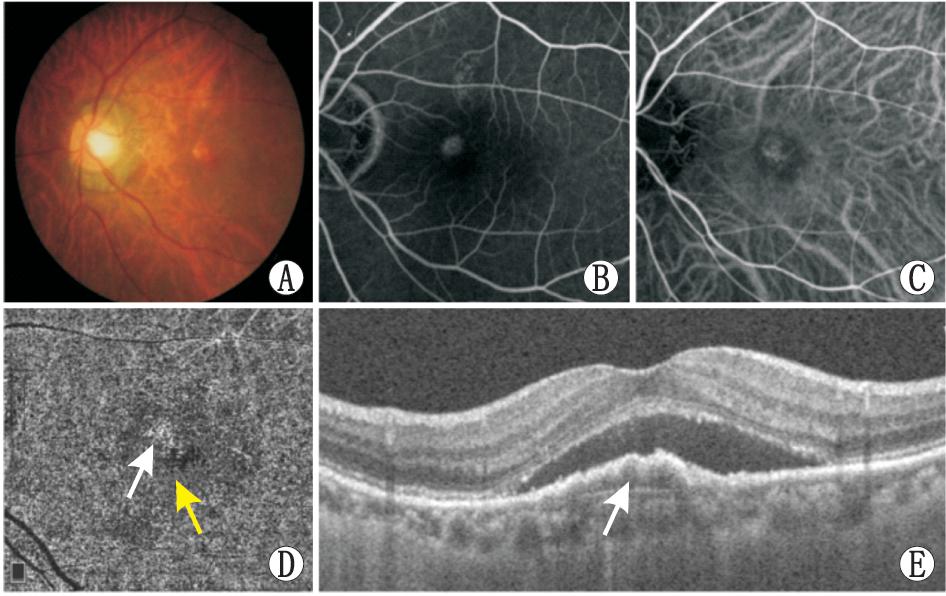
图1 一例53岁CCSC女性患者多模式影像学眼底检查结果
A:彩色眼底照相显示,黄斑区视网膜色素上皮改变;B:FFA检测结果显示,黄斑区斑点状高荧光;C:ICGA检查结果显示,脉络膜血管扩张及高通透性所致强荧光;D:OCTA检查结果显示,患者眼底脉络膜毛细血管层异常血流信号,高血流信号(白箭头)外环绕低血流信号(黄箭头);E:SD-OCT检查结果显示,黄斑区视网膜神经上皮脱离及扁平而不规则的浆液性PED(白箭头)

图2 一例69岁男性PCV患者多模式影像学眼底检查结果
A:彩色眼底照相显示,黄斑区橘红色病灶;B:FFA检测结果显示,斑点状高荧光;C:ICGA检查结果显示,黄斑区息肉样病灶及BVN;D:OCTA检查结果显示,脉络膜毛细血管层BVN(白箭头)及息肉样病灶强信号亮点(黄箭头);E:SD-OCT检查结果显示,黄斑区波浪样隆起的视网膜色素上皮与Bruch膜组成的双层征(白箭头)和PED峰(黄箭头)
3 讨论
中心性浆液性脉络膜视网膜病变(central serous chorioretinopathy,CSC)是一种由于脉络膜毛细血管功能异常,损害视网膜色素上皮引起视网膜神经上皮脱离的黄斑疾病[6]。PCV是一种血管疾病,临床特征为伴有橘红色结节,复发性、浆液性黄斑血管病变[7]。CCSC脉络膜通透性高,渗出液会透过非正常的视网膜色素上皮层,造成视网膜下液体积聚引起视力下降[8]。PCV的异常BVN由新生血管形成,具有渗漏性,会导致黄斑持续水肿和视网膜结构破坏,严重损害患者视力[9]。本研究中PCV组和CCSC组患者均有视力下降,其中PCV组患者视力下降更明显。PCV和CCSC均属于肥厚型脉络膜相关疾病,临床表现相似,难以鉴别;更重要的是二者的治疗方案完全不同;因此我们希望能够结合影像学检查将两种疾病尽量精准鉴别。
FFA检查中PCV和CCSC影像学特征差异不显著,其原因可能是视网膜色素上皮层或脉络膜自身色素遮挡脉络膜血管,不能清晰显示病变特征。ICGA是观察脉络膜血管形态及循环状态的重要手段,是PCV诊断的“金标准”[10]。在ICGA检查结果中,所有PCV患者均发现息肉样病变,而CCSC组患者则表现为脉络膜血管扩张及高通透性,并未发现息肉样病变,说明息肉样病变在两种疾病鉴别中具有特异性。OCTA能有效区分视网膜及脉络膜血流信号,构建微血管网络,可用于血管形态的观察[11]。
本研究对PCV患者的OCTA检查中息肉样病变的检出率为71.4%(15/21)。息肉样病变在OCTA中未完全检出,推测原因可能有:检查的区域有限,不能检查出所有息肉样病变;OCTA成像原理的局限性导致无法检测出一些血流速度慢且体积小的息肉样病变。OCTA在检测脉络膜异常血管网方面具有高度特异性和敏感性[12]。ICGA检测结果显示,BVN病变部位在OCTA相同位置均可观察到异常分支血管形态,检出率相同。Teussink等[13]研究发现,CSC患者脉络膜血流OCTA特征与ICGA检测到的脉络膜血管异常通透性相一致。本研究中两组患者OCTA影像学比较,CCSC患者未见BVN样改变。因此,OCTA检查中BVN对于两种疾病鉴别诊断具有重要意义。
SD-OCT在临床应用多年,能清晰显示视网膜的精细结构。PCV和CCSC在SD-OCT上的表现有共同特征,如视网膜神经上皮脱离和PED。PCV患者的息肉样病变在SD-OCT上常表现为指状突起的PED,即视网膜色素上皮表现为陡峭的强反射光带,其内为中弱反射信号[14]。本研究中21眼PCV患者中有10眼可见指状突起PED的改变,而CCSC患者则未见这类典型形态特征。所以,SD-OCT的影像学表现在两种疾病鉴别诊断中有一定参考价值。PCV患者的SD-OCT检查结果,双层征表现为视网膜色素上皮层扁平而不规则的浅脱离,其下方有一层薄的强信号反射条带,两层反射带之间为中强反射信号,此为BVN所在区域[15-16]。SD-OCT对BVN的检测与OCTA和ICGA检查具有一致性[17]。当CCSC的PED与PCV的双层征形态接近不易区分时,可以结合OCTA检测中是否表现出新生血管形态来明确诊断。
综上所述,CCSC与PCV的多模式影像学检查存在不同特征性表现,两种疾病的鉴别不能单纯依靠一种检查,需综合多模式影像学检查结果进行判断。
参考文献
[1] DANSINGANI K K,BALARATNASINGAM C,NAYSAN J,FREUND K B.En face imaging of pachychoroid spectrum disorders with swept-source optical coherence tomography[J].Retina,2016,36(3):499-516.
[2] WU J S,CHEN S N.Optical coherence tomography angiography for diagnosis of choroidal neovascularization in chronic central serous chorioretinopathy after photodynamic therapy[J].Sci Rep,2019,9(1):9040.
[3] PEIRETTI E,IOVINO C,SACCONI R,CAMINITI G,QUERQUES G.Optical coherence tomography angiography characteristics of polypoidal choroidal vasculopathy secondary to chronic central serous chorioretinopathy[J].Retina,2019,39(9):1693-1700.
[4] CHEUNG C M G,LEE W K,KOIZUMI H,DANSINGANI K,LAI T Y Y,FREUND K B.Pachychoroid disease[J].Eye (Lond),2019,33(1):14-33.
[5] CHAIKITMONGKOL V,KONG J,KHUNSONGKIET P,PATIKULSILA D,SACHDEVA M,CHAVENGSAKSONGKRAM P,et al.Sensitivity and specificity of potential diagnostic features detected using fundus photography,optical coherence tomography,and fluorescein angiography for polypoidal choroidal vasculopathy[J].JAMA Ophthalmol,2019,137(6):661-667.
[6] LIEGL R,ULBIG M W.Central serous chorioretinopathy[J].Ophthalmologica,2014,232(2):65-76.
[7] YANNUZZI L A,SORENSON J,SPAIDE R F,LIPSON B.Idiopathic polypoidal choroidal vasculopathy (IPCV) [J].Retina,2012,32(Suppl 1):1-8.
[8] GAWECKI M,JASZCZUK-MACIEJEWSKA A,JURSKA-JASKO A,KNEBA M,GRZYBOWSKI A.Impairment of visual acuity and retinal morphology following resolved chronic central serous chorioretinopathy[J].BMC Ophthalmol,2019,19(1):160.
[9] DANSINGANI K K,GALOR O,SADDA S R,YANNUZZI L A,FREUND K B.Understanding aneurysmal type 1 neovascularization (polypoidal choroidal vasculopathy):a lesson in the taxonomy of ‘expanded spectra’-a review[J].Clin Exp Ophthalmol,2018,46(2):189-200.
[10] LORENTZEN T D,SUBHI Y,SORENSEN T L.Presenting characteristics and prevalence of polypoidal choroidal vasculopathy in Scandinavian patients with treatment-naǐve exudative age-related macular degeneration[J].Acta Ophthalmol,2018,96(5):475-480.
[11] NAKANO Y,KATAOKA K,TAKEUCHI J,FUJITA A,KANEKO H,SHIMIZU H,et al.Vascular maturity of type 1 and type 2 choroidal neovascularization evaluated by optical coherence tomography angiography[J].PLoS One,2019,14(4):e0216304.
[12] FARECKI M L,GUTFLEISCH M,FAATZ H,ROTHAUS K,HEIMES B,SPITAL G,et al.Characteristics of type 1 and 2 CNV in exudative AMD in OCT-Angiography[J].Graefes Arch Clin Exp Ophthalmol,2017,255(5):913-921.
[13] TEUSSINK M M,BREUKINK M B,VANGRINSVEN M J,HOYNG C B,KLEVERING B J,BOON C J,et al.OCT angiography compared to fluorescein and indocyanine green angiography in chronic central serous chorioretinopathy[J].Invest Ophthalmol Vis Sci,2015,56(9):5229-5237.
[14] TING D S,CHEUNG G C,LIM L S,YEO I Y.Comparison of swept source optical coherence tomography and spectral domain optical coherence tomography in polypoidal choroidal vasculopathy[J].Clin Exp Ophthalmol,2015,43(9):815-819.
[15] BOUSQUET E,BONNIN S,MREJEN S,KRIVOSIC V,TADAYONI R,GAUDRIC A.Optical coherence tomography angiography of fiat irregular pigment epithelium detachment in chronic central serous chorioretinopathy[J].Retina,2017,38(3):1-9.
[16] SENGUPTA S,SURTI R,VASAVADA D.Sensitivity and specificity of spectral-domain optical coherence tomography in detecting idiopathic polypoidal choroidal vasculopathy[J].Am J Ophthalmol,2015,160(1):203-204.
[17] DANSINGANI K K,BALARATNASINGAM C,KLUFAS M A,SARRAF D,FREUND K B.Optical coherence tomography angiography of shallow irregular pigment epithelial detachments in pachychoroid spectrum disease[J].Am J Ophthalmol,2015,160(6):1243-1254.

