注射型富血小板纤维蛋白联合BMSCs在坐骨神经损伤的实验研究
摘 要:目的 探讨注射型富血小板纤维蛋白联合骨髓间充质干细胞(BMSCs)在坐骨神经损伤中的应用效果。方法选择10日龄SD乳鼠6只,雌雄不限,培养纯化BMSCs群备用;另选取2月龄SD大鼠24只,雌雄各半,随机分为观察组与对照组,各12只,以改良挤压损伤法制作大鼠坐骨神经损伤模型,观察组与损伤部位局部注射BMSCs悬液250μl及自体富血小板纤维蛋白250μl,对照组局部注射生理盐水500μl,治疗14 d后,比较治疗前后两组坐骨神经功能指数变化,治疗14 d后大鼠坐骨神经轴突透射电镜图像及腓肠肌湿质量变化情况。结果 治疗前两组坐骨神经功能指数比较,差异无统计学意义(P>0.05);治疗后观察组坐骨神经功能指数低于同组治疗前及治疗后的对照组(P<0.05);治疗14 d后,大鼠坐骨神经透射电镜提示观察组髓鞘轴突比例高于对照组,观察组腓肠肌湿质量高于对照组,且观察组腓肠肌湿质量恢复率高于对照组,差异有统计学意义(P<0.05)。结论 针对坐骨神经损伤大鼠,使用自体注射型富血小板纤维蛋白联合BMSCs进行治疗,能有效提高坐骨神经功能,促进神经修复,提高平滑肌与血管再生能力。
关键词:注射型富血小板纤维蛋白 骨髓间充质干细胞 坐骨神经损伤 再生能力
外周神经损伤后其后续影响及功能恢复的病理生理过程十分复杂,神经组织的修复过程相对缓慢、再生生理较差[1],而且损伤后发生局部粘连、组织萎缩和运动终板退化可能性较大,进而导致神经功能的损伤修复受到影响,是目前显微外科重点与难点问题[2]。干细胞移植作为当今显微外科神经修复治疗的新型手段,骨髓间充质干细胞(BMSCs)是目前较为实用的种子细胞,尤其在外周神经损伤修复过程中发挥重要作用[3]。虽然其临床应用较为广泛,但其仍存有一定不足,如体外培养归巢率低,移植后细胞存活能力欠佳等[4]。注射用富血小板纤维蛋白具有较高的促生长因子释放率,从而更有效地诱导BMSCs的生产与分化[5]。为更好地提高外周神经损伤的修复治疗效果,本研究通过对大鼠应用自体注射型富血小板纤维蛋白联合BMSCs进行治疗,现报道如下。
1 材料与方法
1.1 主要仪器及试剂
DMEM培养基由美国Hy Clone公司提供(生产批号:20180201),十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)配胶试剂盒由上海碧云天生物科技公司提供(生产批号:201811058),CKX41型倒置相差显微镜由日本奥林巴斯公司提供,7000型透射电镜由日本东芝公司提供。
1.2 研究对象
选择10日龄SD乳鼠6只,雌雄各半,体重为25~35 g;另外选择2月龄SD大鼠24只,雌雄各半,体重195~225 g;均购自沈阳医学院实验动物中心(合格证号:20191105)。本研究造模及入组动物选择均通过实验动物伦理委员会审核同意,SD大鼠常温下适应性饲养1周备用。
1.3 方法
1.3.1 大鼠BMSCs及注射型富血小板纤维蛋白的制备
取6只乳鼠采用离颈法处死,采集由DMEM培养基从双侧胫骨干骺端冲洗骨髓,离心管反复吹打制备细胞悬液,随后严格按照密度梯度离心法进行细胞分离、培养和传代,选择培养3周后第4代纯化BMSCs群备用。注射型富血小板纤维蛋白以改良低速离心法进行,具体通过SD大鼠眼眶采血法采集自体血,置于低速离心管内离心3 min后获取浆液层与红细胞层中间的富血小板纤维蛋白层,所制备富血小板纤维蛋白无需抗凝,但要求在制备成功后15 min内应用。
1.3.2分组治疗
将24只2月龄SD大鼠随机分为观察组与对照组,各12只,以改良挤压损伤法制作大鼠坐骨神经损伤模型,先注射3%戊巴比妥实施腹腔麻醉,随后双侧后肢脱毛,无菌条件下对实验侧坐骨神经止血钳上齿挤压45 s,将坐骨神经积压呈扁薄状即为模型制备成功。造模后,观察组与损伤部位局部注射BMSCs悬液250μl及自体富血小板纤维蛋白250μl,对照组局部注射生理盐水500μl,治疗14 d后进行相关结果分析。
1.3.3 观察指标
比较治疗前后两组坐骨神经功能指数变化情况;分析两组治疗14 d后大鼠坐骨神经轴突透射电镜图像结果;统计两组治疗14 d后腓肠肌湿质量变化情况。坐骨神经功能指数为监测神经损伤后恢复情况的一种无创检测手段,以训练小鼠沿限定轨迹走动,并通过后爪不同颜色无毒染料印迹为标准,记录治疗前及治疗14 d后两组实验大鼠沿轨迹行走指标,结合爪长度、脚趾展开长度等综合计算,计算公式选择Bain公式进行,具体为SFI=109.5(ETS-NTS)/NTS-38.3(EPL-NPL)/NPL+13.3(EIT-NIT)/NIT-8.8 (N:正常足;E:伤侧足;PL:足印长度;TS:足趾宽度;IT:中间足趾宽度;),其中SFI=0为正常,SFI=-100为完全损伤;腓肠肌湿质量指标包括:健侧与实验侧腓肠肌湿质量数据,并计算腓肠肌湿质量恢复率,通过十万分之一精度电子天平秤测定治疗14 d后双侧腓肠肌湿质量,腓肠肌湿质量恢复率=实验侧(g)/正常侧(g)×100%。
1.4 统计学方法
采用SPSS 20.0统计学软件进行数据分析,计量资料以均数±标准差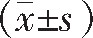 表示,两组间比较使用独立样本t检验,组内比较使用配对t检验,组间率的比较采用χ2检验,以P<0.05为差异有统计学意义。
表示,两组间比较使用独立样本t检验,组内比较使用配对t检验,组间率的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前后坐骨神经功能指数变化的比较
治疗前两组坐骨神经功能指数比较,差异无统计学意义(P>0.05),治疗后两组坐骨神经功能指数低于治疗前,差异有统计学意义(P<0.05);且治疗后观察组坐骨神经功能指数低于对照组,差异有统计学意义(P<0.05)(表1)。
表1 两组治疗前后坐骨神经功能指数变化的比较
2.2 两组治疗14 d后大鼠坐骨神经轴突透射电镜图像
两组大鼠坐骨神经透射电镜提示有髓鞘轴突比例情况提示,治疗14 d后,大鼠坐骨神经透射电镜提示观察组髓鞘轴突比例高于对照组(图1~2)。
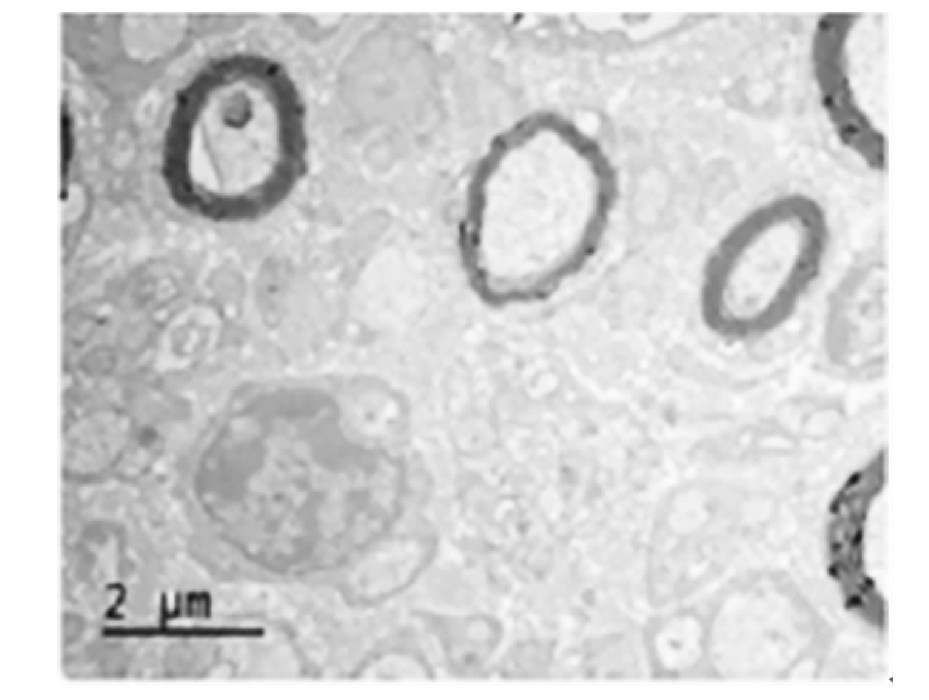
图1 对照组治疗14 d后大鼠坐骨神经轴突透射电镜图(400×)
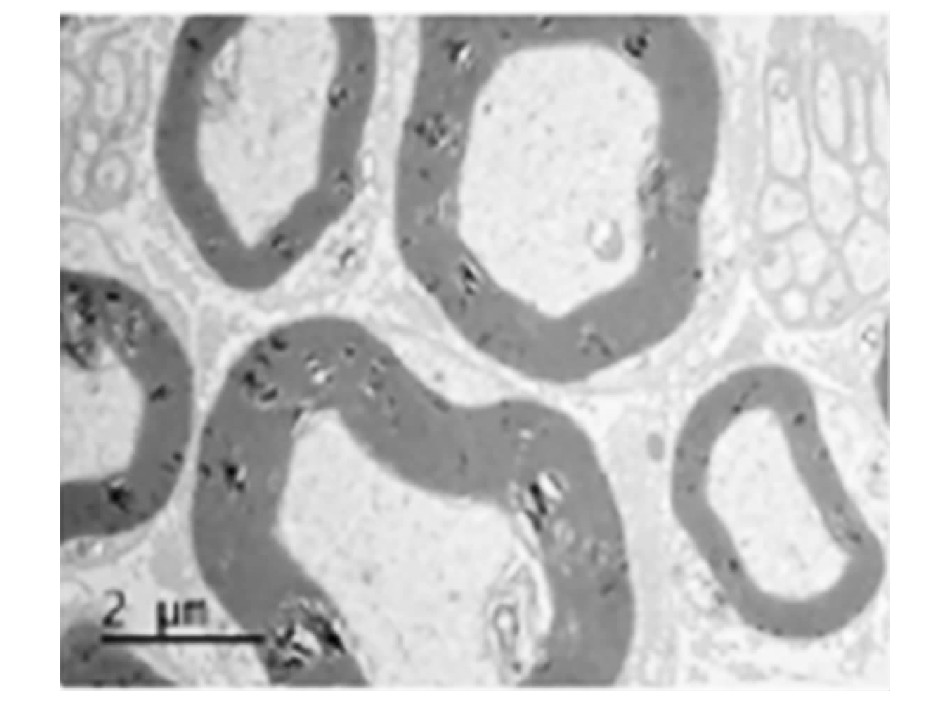
图2 观察组治疗14 d后大鼠坐骨神经轴突透射电镜图(400×)
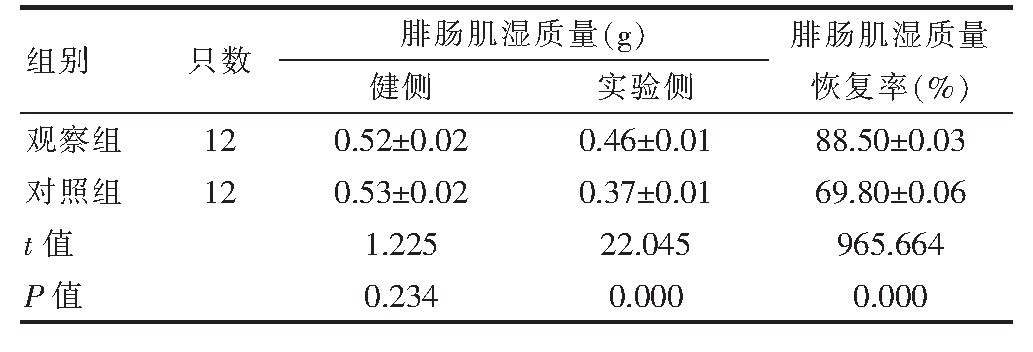
2.3 两组治疗14 d后腓肠肌湿质量变化情况的比较
治疗后两组健侧腓肠肌湿质量比较,差异无统计学意义(P>0.05);治疗后观察组实验侧腓肠肌湿质量高于对照组,差异有统计学意义(P<0.05);治疗后观察组腓肠肌湿质量恢复率高于对照组,差异有统计学意义(P<0.05)(表2)。
表2 两组治疗14 d后腓肠肌湿质量变化情况的比较
3 讨论
神经组织损伤后虽具有一定的组织重塑能力,但随着微环境的改变为出现不可逆性改变[6],进而导致神经修复与再生能力被抑制,给目前临床上针对外周神经损伤的修复其仍属于治疗难点[7]。以往治疗上多以神经电刺激等进行治疗,虽具有一定效果[8],但整体疗效有待提高。近年神经支架、种子细胞及神经营养因子等生物工程手段的临床应用,为神经组织修复带来巨大突破[9]。
针对外周神经损伤,本研究制备大鼠坐骨神经损伤模型,其中观察组使用自体注射型富血小板纤维蛋白联合BMSCs进行治疗,结果显示,治疗前两组坐骨神经功能指数比较,差异无统计学意义(P>0.05);治疗后观察组坐骨神经功能指数低于同组治疗前及对照组治疗后,差异有统计学意义(P<0.05)。证明针对大鼠坐骨神经损伤模型,使用自体注射型富血小板纤维蛋白联合BMSCs进行治疗,相对于注射生理盐水的对照组,能更好地促进坐骨神经功能指数的提高,促进坐骨神经功能的恢复。治疗14 d后,大鼠坐骨神经透射电镜提示观察组有髓鞘轴突比例高于对照组(P<0.05),提示自体注射型富血小板纤维蛋白联合BM-SCs在治疗大鼠坐骨神经损伤方面,促进损伤神经轴突再生具有重要意义。治疗14 d后,观察组腓肠肌湿质量高于对照组,且观察组腓肠肌湿质量恢复率高于对照组,差异有统计学意义(P<0.05),进一步说明针对大鼠坐骨神经损伤模型,自体注射型富血小板纤维蛋白联合BMSCs治疗对促进平滑肌细胞增殖、血管形成等具有重要价值。
BMSCs是一种具有自我更新、多向分化和分泌功能的多能干细胞[10],以旁分泌集落刺激因子、干细胞生长因子、内皮细胞生长因子等多种细胞因子进而调节机体炎症反应,达到促进细胞修复,组织形成的目的[11-12]。另外,本研究使用的自体富血小板纤维蛋白联合BMSCs在神经局部鞘内注射,更好地为神经修复提供充足营养,并在15 min内注射,避免了凝胶状态[13],加大组织流动性,提高了临床应用效果;而且通过其释放的碱性成纤维细胞生长因子,显著提高BMSCs增殖与分化能力,并促进神经细胞的黏附、迁移效应,提高细胞外基质蛋白水平,进而更好地诱导BM-SCs增殖与分化[14-16],促进平滑肌细胞与血管的形成,确保神经组织血管的重塑与增殖,达到修复受损神经的目的[17-18]。
综上所述,针对坐骨神经损伤大鼠,使用自体注射型富血小板纤维蛋白联合BMSCs进行治疗,能有效提高坐骨神经功能,促进神经修复,提高平滑肌与血管再生能力。
参考文献
[1]高海明,王波,曹家全,等.自体注射型富血小板纤维蛋白联合BMSCs治疗大鼠坐骨神经损伤的实验研究[J].中国修复重建外科杂志,2020,15(9):1-6.
[2]吴峥嵘,左园林,李朝晖.自体牙本质颗粒结合富血小板纤维蛋白膜治疗93例下颌第一磨牙根分叉病变效果评价[J].上海口腔医学,2020,29(2):213-216.
[3]Augustine TN,Pather K,Mak D,et al.Ex vivo interaction between blood components and hormone-dependent breast cancer cells induces alterations associated with epithelialmesenchymal transition and thrombosis[J].Ultrastruct Pathol,2020,44(3):262-272.
[4]Brouwers JEIG,van der Vorm LN,Buis S,et al.Implant stability in patients treated with platelet-rich fibrin and bovine bone substitute for alveolar ridge preservation is associated with peripheral blood cells and coagulation factors[J].Clin Exp Dent Res,2020,6(2):236-243.
[5]Goshchynsky V,Migenko B,Lugoviy O,et al.Perspectives on using platelet-rich plasma and platelet-rich fibrin for managing patients with critical lower limb ischemia after partial foot amputation[J].J Med Life,2020,13(1):45-49.
[6]康惠尹,李春宏,苏凯,等.Bio-oss/富血小板纤维蛋白复合物修复牙槽骨缺损区后牙移动的效果及可行性[J].临床和实验医学杂志,2020,19(4):394-397.
[7]Chandra RV,Vaishnavi V,S Chakravarthy YSH.Regenerative capacity of leukocyte-rich and platelet-rich fibrin in dndirect sinus elevation procedure may be dependent on model-specific modification of the centrifugation cycle[J].Contemp Clin Dent,2019,10(3):433-439.
[8]杨忠学,张云涛,张宇,等.葛根素对富血小板纤维蛋白环境下MC3T3-E1成骨细胞生物学性能的影响[J].实用口腔医学杂志,2020,36(1):124-126.
[9]黄奕智,郭俊,杨健.富血小板纤维蛋白对牙周膜成纤维细胞成骨能力影响的实验研究[J].口腔医学研究,2020,36(1):41-45.
[10]Can GD,Akcan G,Can ME,et al.Surgical and immunohistochemical outcomes of scleral reconstruction with autogenic,allogenic and xenogenic grafts:an experimental rabbit model[J].Curr Eye Res,2020,4(5):158-163.
[11]刘燕,何敏,吴於芝.富血小板纤维蛋白牙髓血运重建术联合二联抗生素糊剂治疗年轻恒牙牙髓坏死价值研究[J].创伤与急危重病医学,2020,8(1):45-47.
[12]Wang S,Li Y,Li S,et al.Platelet-rich plasma loaded with antibiotics as an affiliated treatment for infected bone defect by combining wound healing property and antibacterial activity[J].Platelets,2020,12(5):1-13.
[13]陈星光,邹承达,宿广昊,等.负载富血小板纤维蛋白的新型水凝胶对BMSCs体外成软骨分化的影响[J].江苏大学学报(医学版),2018,28(4):291-296.
[14]张中月,黄涛,韩国良,等.骨粉联合富血小板纤维蛋白治疗慢性牙周炎患者骨缺损临床观察[J].中国药师,2019,22(12):2237-2239,2274.
[15]高文香,王明君,李晓峰,等.关节镜下微骨折术联合富血小板血浆与纤维蛋白凝胶覆盖微骨折创面治疗膝骨关节炎软骨退变缺损[J].中医正骨,2019,31(11):21-25,34.
[16]余刚,徐斌,涂俊,等.外周血间充质干细胞复合富血小板血浆对腱骨界面愈合的影响[J].安徽医科大学学报,2017,52(5):770-773.
[17]Fahimipour F,Bastami F,Khoshzaban A,et al.Criticalsized bone defects regeneration using a bone-inspired 3D bilayer collagen membrane in combination with leukocyte and?platelet-rich fibrin membrane(L-PRF):an in vivo study[J].Tissue Cell,2020,63(4):1013-1026.
[18]Bennardo F,Bennardo L,Del Duca E,et al.Autologous platelet-rich fibrin injections in the management of facial cutaneous sinus tracts secondary to medication-related osteonecrosis of the jaw[J].Dermatol Ther,2020,26(5):335-343.
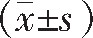 表示,两组间比较使用独立样本t检验,组内比较使用配对t检验,组间率的比较采用χ2检验,以P<0.05为差异有统计学意义。
表示,两组间比较使用独立样本t检验,组内比较使用配对t检验,组间率的比较采用χ2检验,以P<0.05为差异有统计学意义。



